Se puede decir que el enlace de hidrógeno, es una fuerza de Van der Waals dipolo-dipolo, pero de carácter muy fuerte, pero aún más débil de lo que pueden ser un enlace covalente o iónicos normales. Las energías medias del enlace de hidrógeno son bajas, por ejemplo, en el agua, el O-H, posee una energía de enlace intermolecular en torno.. El alza de los tipos de interés, de la inflación y de los precios energéticos, tienen mucho que ver con el retraso al que Esgalhado alude. "Hoy, el hidrógeno es menos competitivo que hace un.

el hidrógeno en su forma natural es gaseoso.,es un elmento químico de aspecto incoloro y
Balnova El Agua y La Camaronicultura Parte I
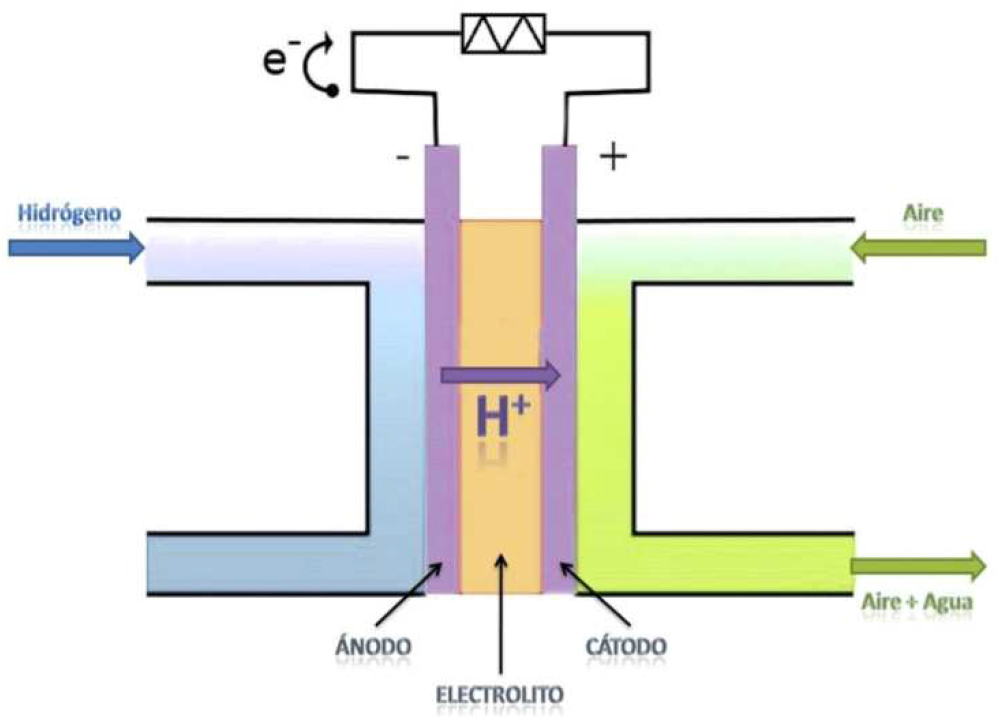
El hidrógeno y la energía Rincón Educativo
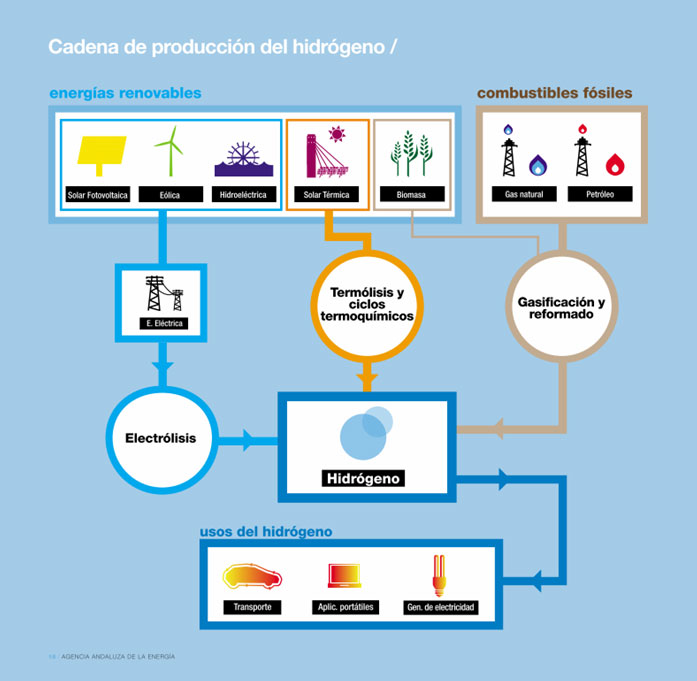
Energía del hidrógeno Agencia Andaluza de la Energía

Símbolo Y Diagrama Del Electrón Para El Hidrógeno Ilustración del Vector Ilustración de modelo
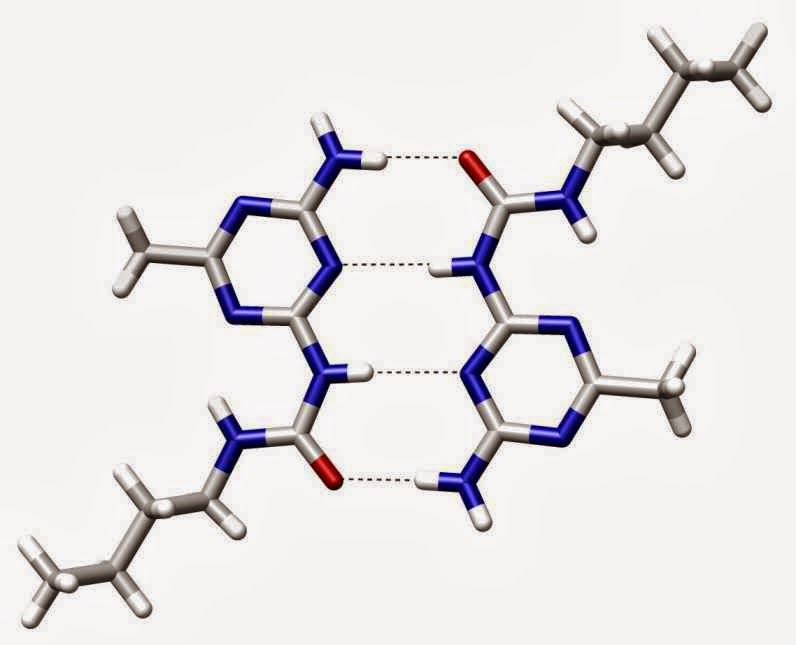
Enlaces químicos y su importancia en biología Biología

Energía a partir del hidrógeno es garantía de desarrollo Energía Hoy
Hidrógeno conceptos básicos del combustible del futuro

Energía del Hidrógeno Fuentes y Aplicaciones en Energía Limpia
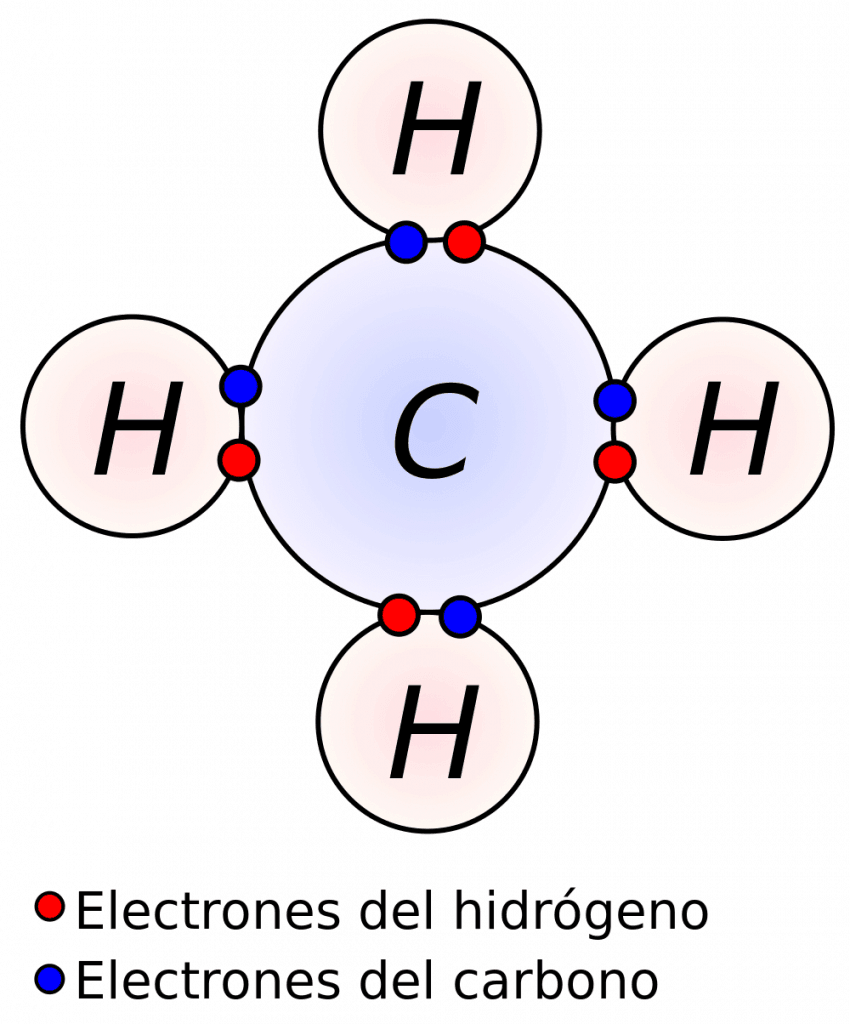
¿Qué es el enlace químico y cuántos tipos hay? Curiosoando

Bioquimica ENLACE Polares o Ionico Covalente Puente de Hidrogeno

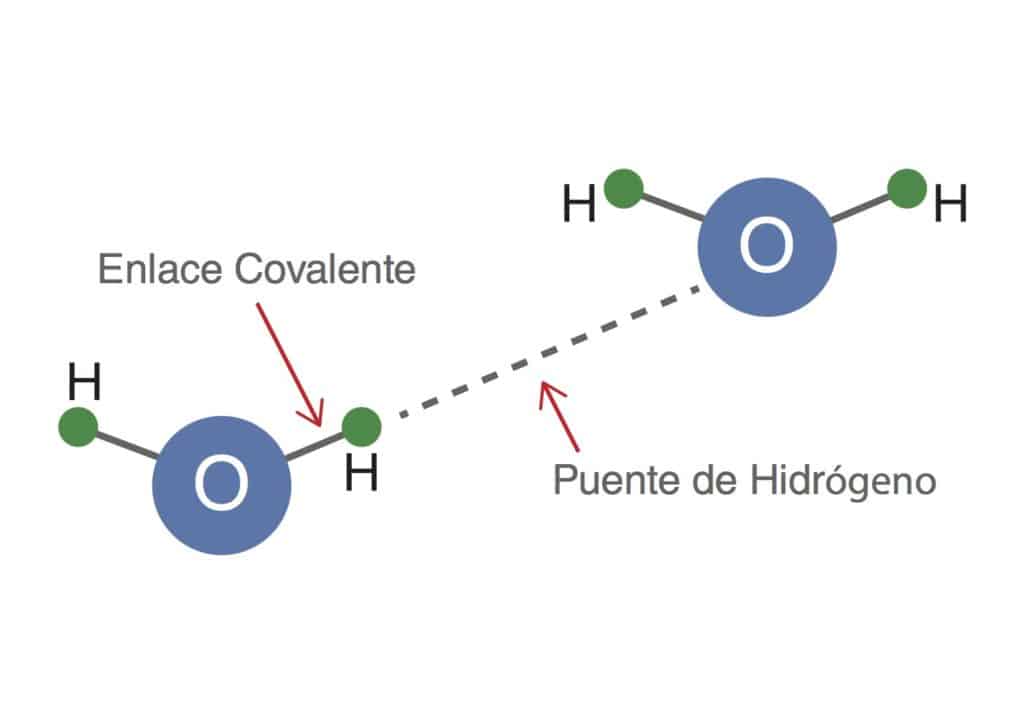
Enlaces de hidrógeno Escuelapedia Recursos EducativosEscuelapedia Recursos educativos
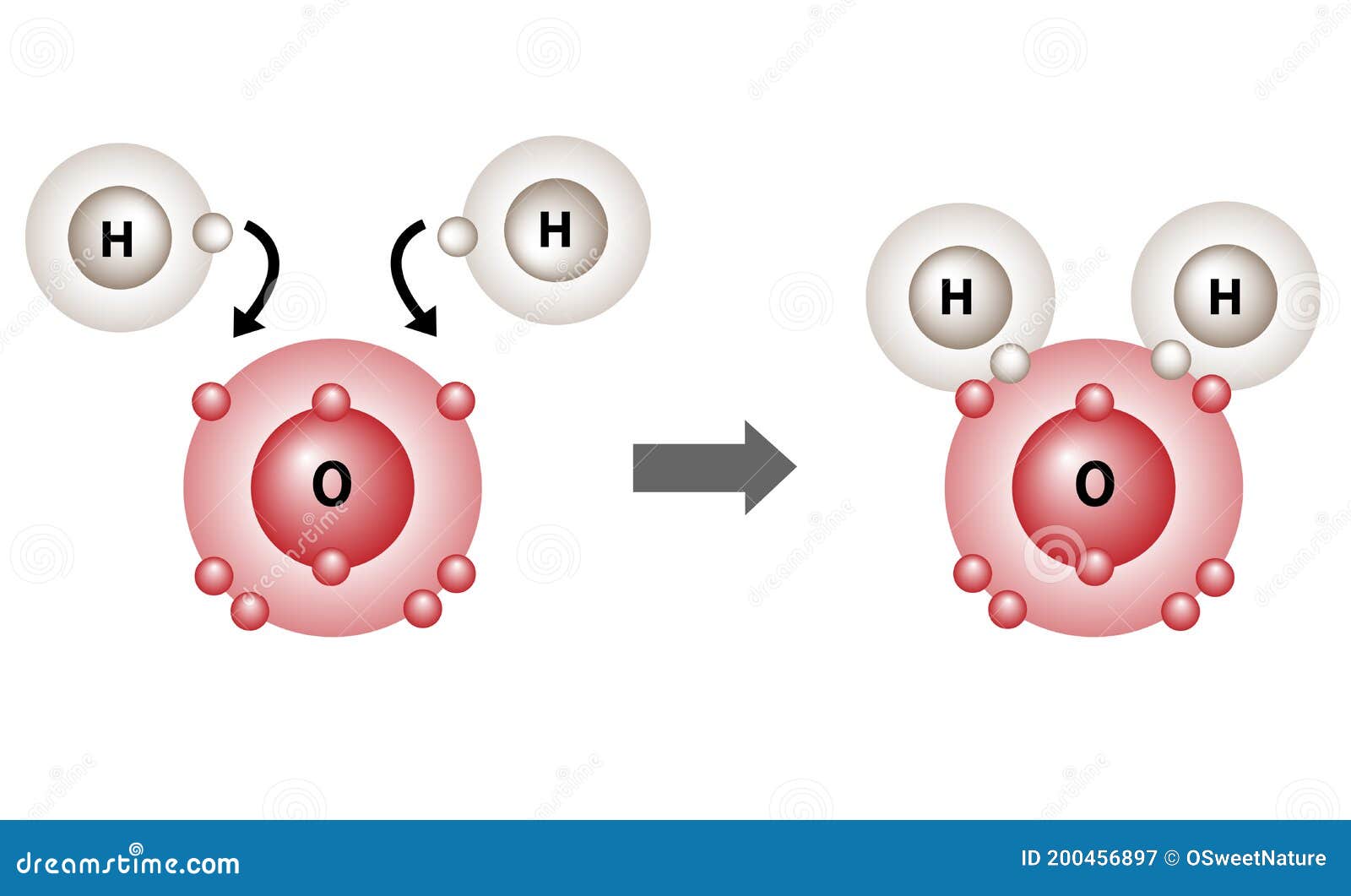
Estructura De Unión Del Hidrógeno Y El Oxígeno De Las Moléculas De Agua Stock de ilustración

Enlace Químico

Niveles de Energía Del Hidrógeno Configuración electronica Espectro electromagnético
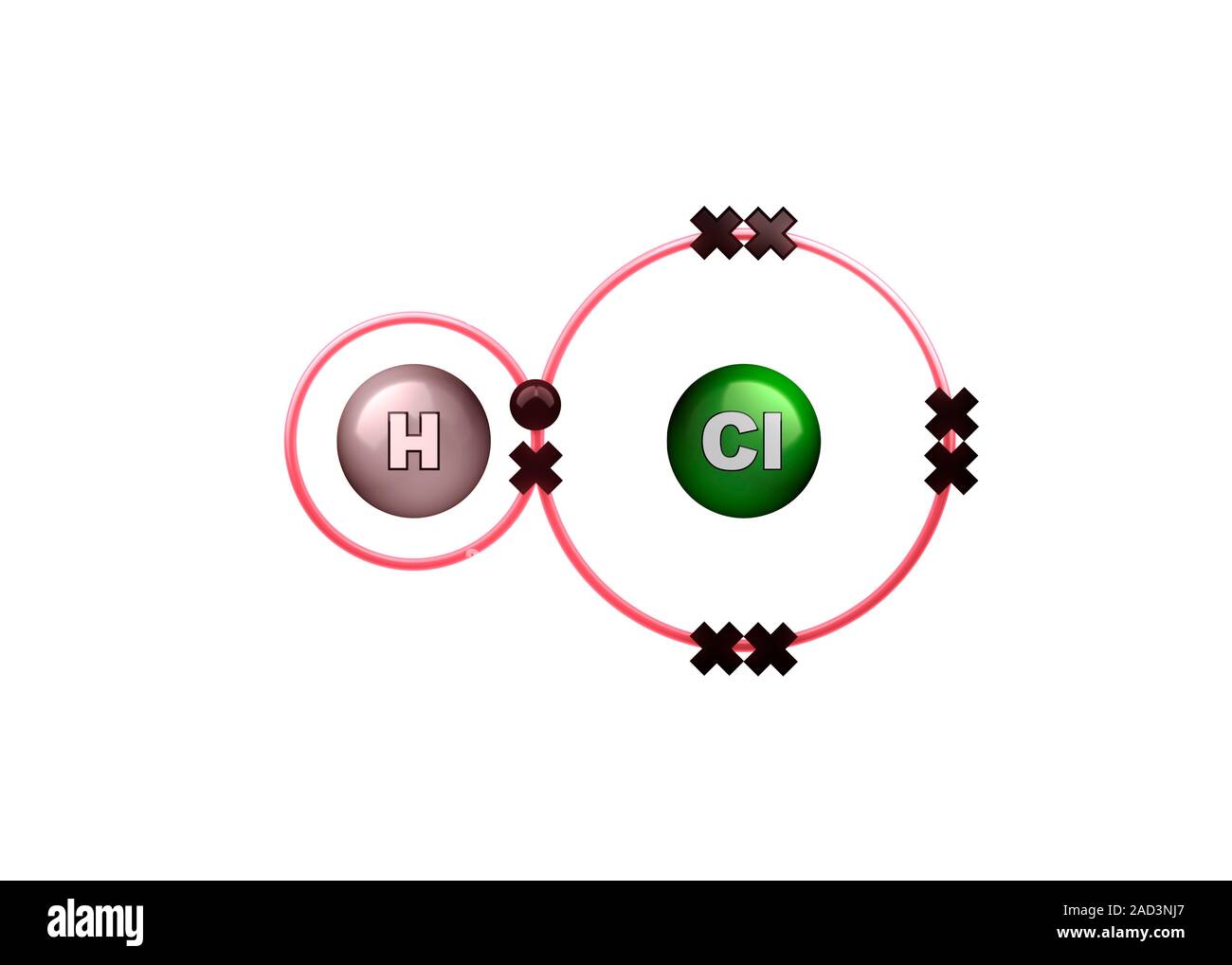
Enlace polar en la molécula de cloruro de hidrógeno. Imagen 2 de 3 ilustrando la compartición de

¿Qué sabemos acerca del hidrógeno en la energía? Hala Bedi

isótopos de hidrógeno. Estructura atómica del hidrógeno1 al hidrógeno3. Partículas atómicas
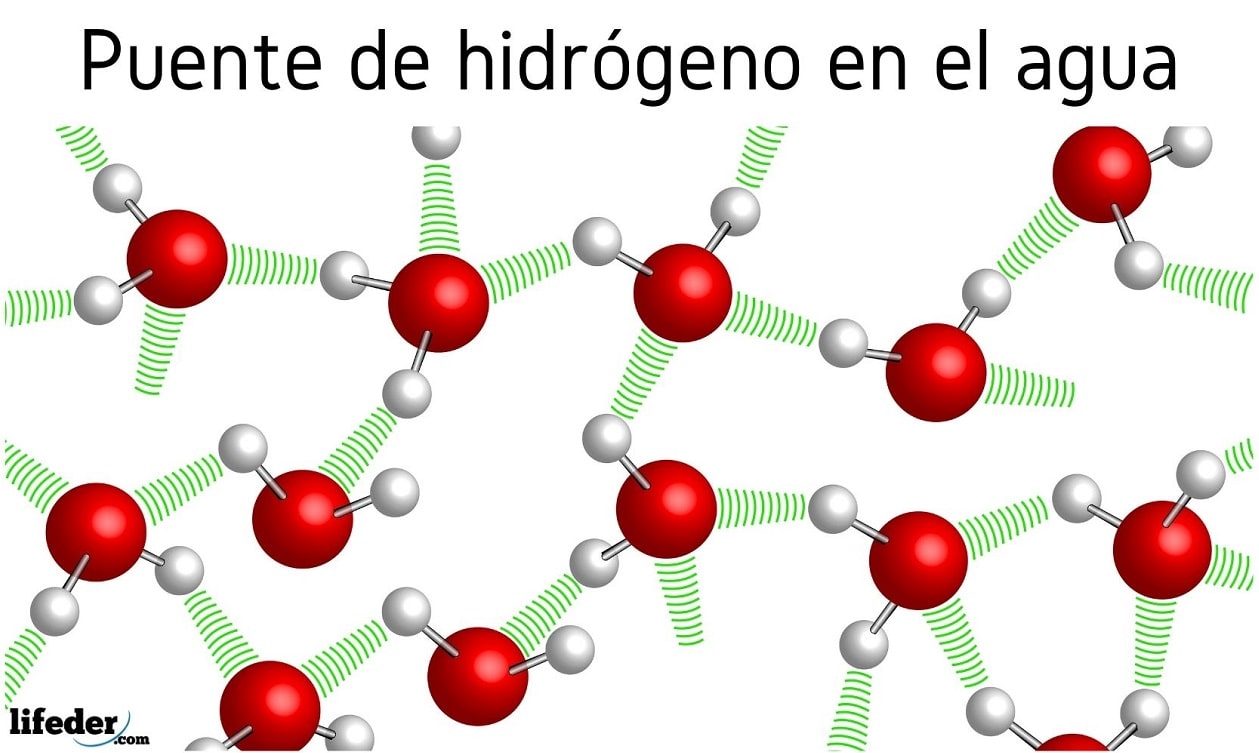
Enlace por puente de hidrógeno características, ejemplos
el hidrogeno como fuente de energia hidrogeno como fuente de energia
Energía de enlace. Concepto: la energía total promedio que se desprendería por la formación de un mol de enlaces químicos. Energía de enlace, es la energía necesaria para romper un mol de dichos enlaces. Las partículas se atraen unas a otras por alguna fuerza, que en contacto inmediato es excesivamente grande, a distancias pequeñas.. Entalpía de reacción. En las reacciones químicas, los enlaces entre átomos pueden romperse, reconstituirse o experimentar ambos procesos, ya sea para absorber o liberar energía. El resultado es un cambio de la energía potencial del sistema. El calor que absorbe o libera un sistema sometido a presión constante se conoce como entalpía, y.